在2019年11月22日至11月24日于新加坡举行的2019年欧洲肿瘤学会亚洲分会ESMO-Asia年会上,金沙8888js官方分享了(抗EGFR单抗)治疗晚期实体瘤疗效及安全性的1期临床试验( NCT02648490)最新研究进展,该研究结果被评选为本届会议“最佳壁报”之一。
以下为本次数据发布的详细信息:
HLX07
论文题目:A Novel Anti-EGFR Antibody HLX07 for Potential Treatment of Squamous Cell Carcinoma of the Head and Neck
讲者:侯明模 林口长庚纪念医院
壁报编号:68P
时间:2019年11月23日18:00-18:30
地点:新加坡新达城国际会议展览中心展览大厅level4
HLX07是金沙8888js官方自主研发的改良型重组抗表皮生长因子(EGFR)人源化单克隆抗体注射液。临床前研究显示,在经过包括人源化改造、亲和力成熟及稳定细胞株建构等一系列改良后,与国内已获批的抗EGFR单抗西妥昔单抗(Cetuximab)相比,HLX07在不同肿瘤模型及在相同药物剂量下,显示出等效甚至更佳的肿瘤抑制效果和更低的毒性。
试验设计
金沙8888js官方开展了一项前瞻性、开放性式、剂量递增的1期临床试验,旨在评价不同剂量的HLX07在经标准治疗失败后的晚期实体瘤患者中的安全性、耐受性、药代动力学(PK)特性和有效性。该试验采用传统的3+3剂量递增方案,每个剂量组至少入组3例患者。入组后,患者每周静脉输注HLX07(50,100,200,400,600和800mg)直至疾病进展(PD),撤销知情同意或死亡(由事件发生顺序决定)。首次给药28天内,评估剂量限制性毒性 (DLT),每8周通过计算机断层扫描(CT)或磁共振成像(MRI)评估一次临床疗效。
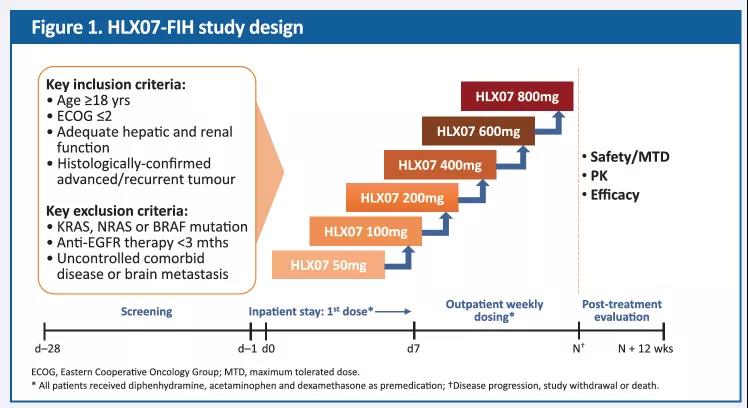
图1. 试验设计
试验结果
该试验在中国台湾开展。截至2019年6月13日,共入组患者19例,其中男性患者占84.2%,中位年龄为58岁。
有效性结果
在17例可评估的患者中,在600mg剂量组观测到1例部分缓解(PR),在所有剂量组有5例疾病稳定(SD)。
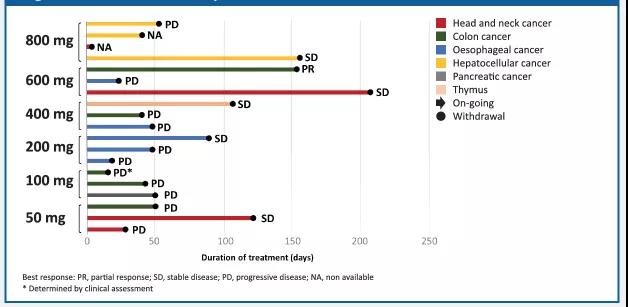
图2. HLX07有效性结果
药动学结果
随着HLX07剂量的增加,药动学参数与计量呈正相关性。
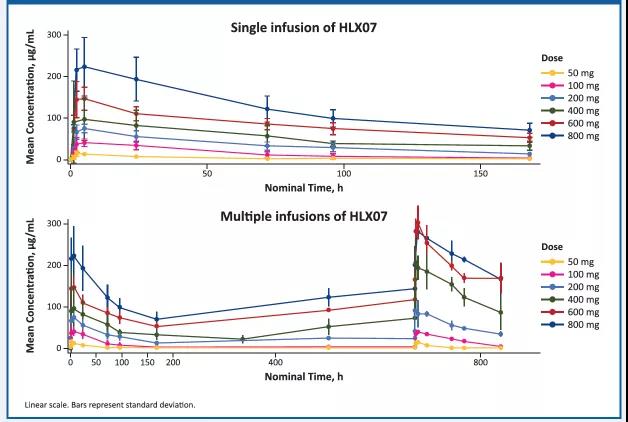
图3. HLX07 平均血药浓度(SD)-时间曲线
安全性结果
HLX07显示出良好的安全耐受性。直至最高剂量组(800mg剂量组),试验中均未出现剂量限制性毒性(DLT),也未达到最大耐受剂量(MTD)。6个剂量组中均未发现明显的、超出预期的不良事件。
结论
•HLX07显示出良好的安全耐受性:直至最高剂量组(800mg剂量组),试验中均未出现剂量限制性毒性(DLT),也未达到最大耐受剂量(MTD)。
•HLX07显示良好的肿瘤抑制效:17例可评价的患者中有1例部分缓解(PR),5例疾病稳定(SD)。
•此结果支持了HLX07开展其1b/2期临床试验(NCT03577704),进一步验证HLX07联合不同化疗方案在晚期实体瘤患者中的安全性和有效性。
