9月20日下午,在第21屆全國臨床腫瘤學會(CSCO)年會的國際白血病·淋巴瘤專場上,中國醫學科學院腫瘤醫院石遠凱教授公佈了復宏漢霖HLX01與原研利妥昔單抗相似性研究3期臨床試驗資料。

會上,石遠凱教授報告了HLX01與原研利妥昔單抗治療彌漫大B細胞淋巴瘤(DLBCL)的多中心、隨機、雙盲、頭對頭對照3期研究結果,該研究表明,HLX01組與原研利妥昔單抗組療效等效性成立。

研究目的
在DLBCL患者中,以原研利妥昔單抗聯合CHOP方案(環磷醯胺、多柔比星、長春新堿及強的松)作為陽性對照,比較HLX01聯合CHOP作為一線治療方案的臨床療效及安全性。
研究終點
主要研究終點為比較試驗組和對照組對初治DLBCL患者6週期內的ORR,包括完全緩解(CR)及部分緩解(PR); 次要終點包括完全緩解率、1年反應持續時間 (DOR)、1年無事件生存(EFS)率、1年無進展生存(PFS)率、1年總生存(OS)率、1年無病生存(DFS)率及群體藥效動力學(PD)參數。
研究結果
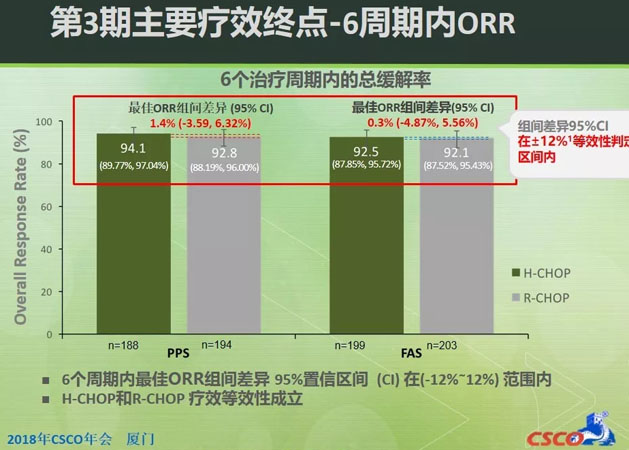
HLX01第3期臨床試驗證實了HLX01與原研利妥昔單抗的療效和安全性相似。HLX01與原研利妥昔單抗聯合CHOP的6個週期內最佳總緩解率為92.5%比92.1%(全分析集)。組間差異95%置信區間(CI)在預設的等效區間內(-12%~12%),療效等效性確立。
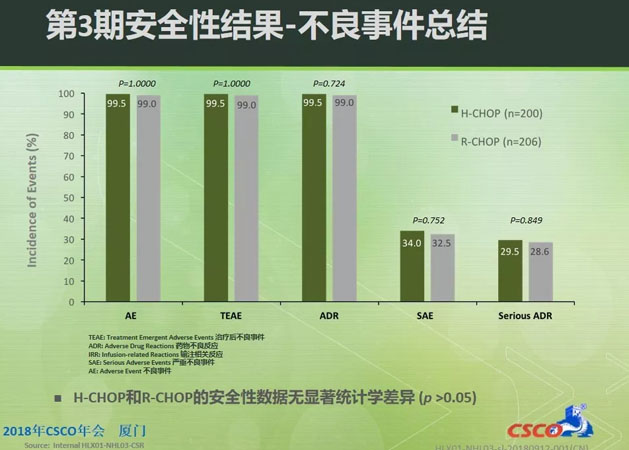
在安全性方面,HLX01和原研利妥昔單抗的不良事件(AE)、治療後不良事件(TEAE)和嚴重不良事件(SAE)資料均相似,無統計學差異。免疫原性的研究結果顯示兩組的抗藥抗體(ADA)陽性率也相近。以上3期臨床試驗結果表示,HLX01具有與原研利妥昔單抗相似的療效和安全性。
關於HLX01
HLX01為復宏漢霖自主研發的首個單克隆抗體生物類似藥,主要適用于非霍奇金淋巴瘤(NHL)、類風濕性關節炎(RA)的治療。其原研藥於1997年獲得美國FDA批准,是第一個用於腫瘤治療的單克隆抗體藥物。值得關注的是,2017年9月,HLX01已收到上海食藥監局頒發的《藥品生產許可證》。2017年10月,復宏漢霖就HLX01向CFDA遞交新藥上市申請(NDA)並獲受理,這也是中國自主研發的第一個真正意義上以生物類似藥路徑申報上市的單抗生物藥。
關於復宏漢霖
上海復宏漢霖生物技術股份有限公司由復星醫藥與海外科學家團隊于2009年12月合資組建,公司主要致力於應用前沿技術進行生物類似藥、生物改良藥以及創新型單抗的研發及產業化,在中國上海、臺北和美國加州均設有研發中心,產品覆蓋腫瘤、自身免疫性疾病等領域。
截至目前,復宏漢霖12個產品、1個聯合治療方案已完成20項適應症的臨床試驗申請,累計獲得全球範圍內25個臨床試驗許可(中國大陸15個,中國臺灣3個,美國3個,歐盟、澳大利亞、烏克蘭和菲律賓各1個)。
