編者按:在剛剛落幕的2019年歐洲腫瘤內科學會(ESMO)年會上,來自德國Essen-Mitte診所乳腺中心的Sherko Kümmel教授報告的國產曲妥珠單抗HLX02治療轉移性乳腺癌的3期臨床試驗(HLX02-BC01)取得了積極的陽性結果,引起了眾多國際腫瘤學專家的關注。會後,《腫瘤瞭望》採訪了研究的leading PI中國醫學科學院腫瘤醫院的徐兵河教授和烏克蘭Dnipropetrovsk醫學科學院的Igor Bondarenko教授。基於此陽性結果,國產曲妥珠單抗HLX02的上市申請已經獲得NMPA和EMA接受。該生物類似葯的上市將有效降低治療成本,為中國乃至全世界HER2陽性乳腺癌患者帶來更多的治療選擇!
《腫瘤瞭望》:本次ESMO大會報告了國產曲妥珠單抗HLX02治療轉移性乳腺癌的3期臨床試驗結果。請介紹一下其背景和研究設計。
Prof. Bondarenko:轉移性乳腺癌是導致全球女性死亡的原因之一。據統計,全球每年有約200萬人被診斷為乳腺癌,並大約有71 300人死於乳腺癌。人類表皮生長因子受體2(HER2)的高表達或擴增定義了一組不同的乳腺癌,約佔乳腺癌整體人群的20%。此類疾病更具侵襲性,患者預後差。然而,腫瘤對HER2的依賴也提供了靶向治療。得益於HER2人源化單克隆抗體曲妥珠單抗這樣的現代藥物,在過去15年里對HER2陽性乳腺癌的治療取得了真正的突破。雖然曲妥珠單抗治療已經使得HER2陽性乳腺癌患者的整體預後得到改善,但晚期轉移性疾病對於大多數患者仍然治療效果不佳,大約50%的患者晚期患者在治療後1年內發生疾病進展。
曲妥珠單抗最初被評估用於轉移性患者的一線治療,其在患者進展期的維持治療也已成為一種常見做法,可改善患者的預後。然而,曲妥珠單抗的使用對患者和醫療保健系統具有重大的成本影響。這就是為什麼我們參與了這項HLX02-BC01研究以及其他評估生物類似葯研究的原因,此類潛力巨大的生物類似葯以其3~5倍的更低價格可以使患者節約治療成本。就個人而言,我已經看到研究者對評價兩個治療組總有效率(多西紫杉醇聯合標準治療或Henlius產品HLX02)的3期雙盲研究結果,兩者非常相似。我要向我們在中國的合作夥伴表示祝賀,祝賀這次試驗取得的巨大成功和積極成果。
徐兵河教授:曲妥珠單抗與化療聯合應用顯著改善了HER2陽性乳腺癌患者的臨床預後;然而,其高昂的製造成本推高了價格,導致獲得這種有效治療的機會有限。HLX02是復宏漢霖遵照中國NMPA及EMA的指導原則開發的曲妥珠單抗生物類似葯,以支持全球發展。遵循逐步開發生物類似葯的臨床方法,我們先前在2018 CSCO、ESMO Asia 2018上報道了HLX02、歐盟來源曲妥珠單抗和中國來源曲妥珠單抗的1期臨床葯代動力學、安全性和生物等效性研究。
在這次ESMO大會上,我們報道了國際多中心的、隨機雙盲的3期臨床試驗(HLX02-BC01研究),以比較HLX02和歐盟來源曲妥珠單抗聯合多西他賽治療複發或未經治療的轉移性乳腺癌的療效和安全性。這項研究已經達到了主要終點,即經過8個療程治療後到第24周的最佳總客觀反應率(ORR24)。我們還報告了其他期中分析數據,包括CBR、DCR、DoR、PFS、OS在總體和亞組(亞洲vs非亞洲)分析中的結果。
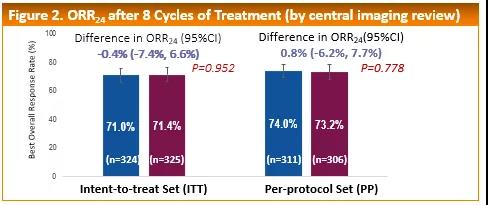
《腫瘤瞭望》:請進一步介紹此次ESMO大會上報道的HLX02-BC01研究陽性結果,以及您對此陽性結果的評論。
徐兵河教授:與歐盟來源曲妥珠單抗相比,國產曲妥珠單抗HLX02 24周的使用產生了等效的ORR。主要結果ORR24分別為71.0%(HLX02)和71.4%(歐盟來源的曲妥珠單抗),兩組差異無統計學意義(p=0.952),且ORR組間差異(-0.4;95%CI:-7.4%~6.6%)也在預設等效範圍內(±13.5%)。與歐盟來源的曲妥珠單抗相比,國產曲妥珠單抗HLX02沒有報告新的安全性問題。次要療效和安全性終點也支持國產曲妥珠單抗HLX02和歐盟來源曲妥珠單抗相似。
此次期中分析的陽性結果支持了國產曲妥珠單抗HLX02向中國國家藥品監督管理局(NMPA)遞交新葯上市申請(NDA),以及向歐洲藥品管理局(EMA)遞交上市許可申請(MAA)。並被雙雙接受。HLX02成為迄今為止中國第一個根據NMPA和EMA生物類試藥指南開發的曲妥珠單抗生物類似葯,一旦獲批,將成為第一個在中國境外獲得批准中國生物類似葯。
Prof. Bondarenko:值得一提的是,這項隨機雙盲設計的3期試驗,採用了人用藥品註冊技術要求國際協調會(ICH)有關臨床試驗質量管理規範(GCP)的循證醫學標準。我們知道HLX02-BC01研究的主要終點是ORR24,這兩個治療組結果均大約為71%。本研究的主要療效結果與輝瑞Trazimera研究中的ORR25(PF-05280014組為62.5%;赫賽汀組為66.5%)以及Ogivri Mylan研究中的ORR24(Myl-1401o組為69.6%;赫賽汀組為64.0%)非常相似,這是最近兩項轉移性乳腺癌的曲妥珠單抗生物類似葯研究。在我們的中心所納入的22名患者中,也同樣沒有觀察到兩個治療組之間的任何差異。
基於該研究的期中分析結果,歐洲藥品管理局(EMA)已接受了中國產曲妥珠單抗HLX02提交的上市許可申請(MAA)。Henlius也在中國提交了HLX02的新葯申請,並得到了NMPA的優先審評。因此,這項研究的結果對許多患者和國家都是好消息。因為在不同國家,由於缺乏藥物資金或治療費用等各種原因,曲妥珠單抗的使用受到一定限制。
《腫瘤瞭望》:在最近的NCCN乳腺癌指南中,也將生物類似葯納入推薦。你認為這次更新有什麼意義?像HLX02這樣的生物類似葯將如何影響臨床實踐?
徐兵河教授:我們知道HER2陽性乳腺癌的治療已經取得了很大的進展,但仍有許多患者因葯價過高而無法得到足夠的治療。在NCCN指南的制定過程中,要求委員會以成本不敏感的方式制定準則,提出他們認為最好的臨床治療方案。但如果能夠以更低的成本提供同樣高質量的臨床用藥,將有效促進市場的持續創新和改進。大多數生物製品的極高價格迫使人們尋找替代選擇,例如開發生物類似葯。
生物類似葯通常與原研產品高度相似,在安全性和有效性方面沒有臨床意義的顯著差異。應用安全有效的曲妥珠單抗HLX02可能是HER2陽性乳腺癌患者獲得這一關鍵治療的機會。此外,HER2靶向藥物可長時間使用,並與其他全身治療相結合;HLX02可為醫療保健系統節省開支,尤其是HLX02的可用性能夠解決患者和臨床醫生未滿足的需求。
Prof. Bondarenko:沒有必要讓所有的病人都接受原研葯。已經獲批上市的原研葯如果還沒有進入基金或報銷,醫生可能也會決定不開原研葯處方。歐洲各地對抗HER2治療的補償也各不相同,這可能會讓患者在獲得曲妥珠單抗治療方面造成差異。這就是為什麼NCCN幾年前就提出了他們對生物類似葯的立場,不僅對中國人,而且對全世界的患者。
我參加了乳腺癌、肺癌、淋巴瘤等8項生物類似葯的研究。迄今為止,其中一些試驗的結果僅在國際腫瘤大會上公布,這些生物類似葯與參考產品高度相似。與原研葯(上市前臨床試驗)的嚴格評審相比較,生物類似葯的監管框架提供了一種更為量身定製的審批途徑。我相信HLX02和參考曲妥珠單抗高度相似的研究結果將對臨床實踐產生積極的影響。因此,HLX02可能提供一種較低成本的替代品來替代參考曲妥珠單抗,並有可能產生成本節約。
《腫瘤瞭望》:此次期中分析的陽性結果,有力支持了HLX02向中國NMPA和EMA遞交上市申請。HLX02一旦獲批,今後我們應如何更好地使用這種生物類似葯?
徐兵河教授:HLX02是首個被EMA接受,並有潛力成為第一個獲批的中國曲妥珠單抗生物類似葯。臨床醫生需要了解什麼是生物類似葯,以及如何將HLX02以一種持續增加患者獲益價值和提供最佳護理的方式結合起來。使用經批准的曲妥珠單抗生物類似葯進行治療與使用對照藥品進行治療具有同樣的療效和安全性。
Prof. Bondarenko:近年來,生物類似葯作為原研製劑的有效替代品在世界範圍內引起了極大的興趣。近十年來,生物類似葯一直是歐盟臨床實踐的一部分。一些曲妥珠單抗生物類似葯最近也在歐洲獲得批准。在烏克蘭,我們可能並非是這些研究的主要領導者,但我們協助其他公司開發生物類似葯,並且我們關注來自韓國、中國等許多其他國家製藥公司的研發動態。這些生物類似葯與原研葯高度相似,儘管在臨床活性成分方面存在微小差異,與對照品相比在安全性、純度或療效方面沒有臨床意義的差異。向我國引進一種像HLX02這樣的低成本生物類似葯,可以使曲妥珠單抗具有成本效益,並支持藥物籌資和報銷的決定,從而改善HER2陽性乳腺癌患者獲得充分抗HER2治療的機會。
關於這項研究(HLX02-BC01),重要的是Henlius的藥物研發確實達到了非常高的國際標準。這項研究涉及中國、烏克蘭、菲律賓和波蘭的多個中心。我們的研究人員在研究的設計和實施過程中嚴格遵循高國際標準,做了出色的貢獻。我相信,在如此高的ICH/GCP標準下進行的這項研究也可能滿足歐洲和其他國家的市場批准要求。

